Минздрав назвал число участников проверки безопасности вакцины от.COVID-19  «Минздрав»
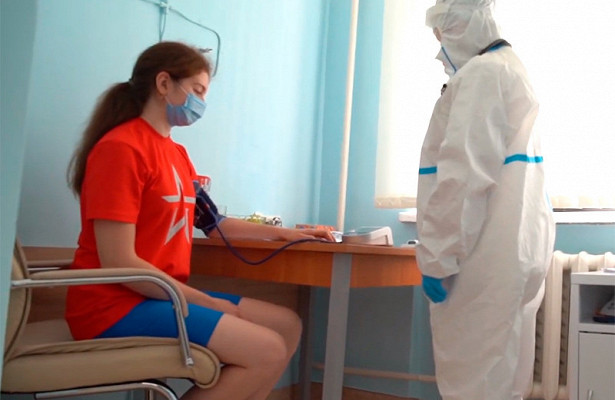
К моменту государственной регистрации первой из разрабатываемых в России вакцин от коронавирусной инфекции COVID-19 ее безопасность была проверена на 20 участниках испытаний. Об этом сообщает «Фармацевтический вестник» со ссылкой на записи в международном и российском реестрах клинических исследований, а также данные на сайте Минздрава.
В опубликованной на сайте ведомства инструкции по применению вакцины «Гам-КОВИД-Вак», разработанной Национальным исследовательским центром эпидемиологии и микробиологии имени Н. Ф. Гамалеи (НИЦЭМ), говорится, что в ходе испытаний в режиме прайм-буст вакцина была введена 20 добровольцам. Это означает, что 20 человек получили оба компонента препарата в соответствии с той схемой, которую предполагается использовать при массовой вакцинации. Остальные 18 участников получили только один из компонентов — либо первый, либо второй. Аналогичные данные размещены в международном реестре cliicaltrials.gov.
Вакцина пока запрещена для применения на людях старше 60 лет и младше 18 лет.
Вице-президент Российского научного общества иммунологов профессор Иван Козлов сказал «Фармвестнику», что регистрация вакцины ведется по ускоренной схеме. «В случае лечения орфанных заболеваний никого не смутит побочный эффект в виде диареи. Пациент умирает, соотношение польза и риск адекватное. Вакцинация же относится к профилактике. Это принципиально иная ситуация. У нас абсолютно здоровый человек, но мы опасаемся, что он может тяжело заболеть. Однако он также может заболеть после введения препарата», — сказал Козлов.
Он подчеркивает, что дилемма особенно остро стоит с учетом планов по массовой вакцинации, когда пациент «укололся и ушел». «Я вообще не представляю, как проводить массовую вакцинацию против COVID, — признается Козлов. — Мы прививаем здорового человека. Поэтому, когда он приходит на процедуру, мы сначала должны сделать экспресс-тест на COVID, ибо больного прививать мы не можем. Дальше необходимо провести такой же экспресс-тест на антитела, поскольку вакцина иначе инактивируется. После прививки 28 дней отводится для выработки адаптивного иммунного ответа. То есть мы должны будем изолировать человека и фактически на спецмашине отвезти в „красную“ зону. Ведь если он выйдет после укола и его кто-то заразит, то существует риск осложнения в виде цитокинового шторма (потенциально летальная реакция иммунной системы, например, сепсис. — Прим. NEWSru.com)».
В свою очередь, принимавший участие в обсуждении новой вакцины от коронавируса заведующий специализированным научно-исследовательским отделом по профилактике и борьбе со СПИДом Центрального НИИ эпидемиологии Роспотребнадзора, академик РАН Вадим Покровский заявил, что поддерживает массовую вакцинацию в принципе, но сам не будет прививаться российской вакциной до окончания третьей фазы испытаний. «В любом случае надо прививать некоторые группы населения. Это, например, больные диабетом, возрастная группа старше 60-65 лет. Сейчас уже ясно, что они подвергаются большому риску. Но сам я, конечно, подожду, пока будут результаты третьей фазы. Думаю, что большинство пропустит этот сезон», — сообщил Покровский на онлайн-конференции «Пандемия COVID-19 — мировой опыт и локальные инициативы» 18 августа.
По его словам, китайская вакцина практически готова к третьей фазе испытаний, и по ее результатам будет ясно, какая лучше. А через год-полтора у граждан будет выбор из не менее чем десятка «хороших, перспективных вакцин» только в России.
В то же время Вадим Тарасов, директор Института трансляционной медицины и биотехнологии Сеченовского университета, где проходили исследования вакцины, пояснил РБК, что задачей испытаний было доказать ее безопасность и это в какой-то мере было сделано.
"Насчет иммуногенности можно говорить о предварительных выводах, именно поэтому препарат и зарегистрирован «на условиях». Условиями и являются расширенные пострегистрационные исследования, где и можно судить об иммуногенности. Нужно учитывать, что исследования безопасности предварительные и предстоят пострегистрационные исследования. Никто не говорит о получении окончательных данных", — сказал Тарасов.
Исследования первой и второй фаз выполнены в соответствии с правилами организации клинических исследований, где анализировалась иммуногенность вакцины. Она оценивалась по наличию иммуноглобулинов. «Для получения статистической разницы по их наличию этого было достаточно, то есть иммуногенность была продемонстрирована хорошая, — сказал и. о. председателя Совета по этике при Минздраве, член-корреспондент РАН Александр Хохлов. — Но, чтобы получить популяционные сведения, понятно, что требуются большие выборки, что сейчас и планируется проводить. Нередко вторая фаза исследований проводится на ограниченной популяции, насколько я помню, антитела были выявлены у всех».
Создатели российской вакцины настаивают, что ее нельзя считать продуктом исследования пяти месяцев. Основа вакцины была создана несколько десятков лет назад и имеет большой срок применения, заявил заместитель директора Центра имени Н. Ф. Гамалеи по научной работе Денис Логунов. «Неправильно говорить, что нам удалось создать вакцину с нуля за короткие сроки. Начиная с момента разработки технологии аденовирусных векторов* до ее внедрения в практику прошло уже четыре десятка лет. За эти четыре десятка лет была создана технологическая платформа, которая была апробирована на десятках тысяч людей как на основе вектора пятого серотипа, так и на основе 26-го. Всего с 2015 года вакцинами на основе аденовирусных векторов, разработанными в Центре им. Н. Ф. Гамалеи, было провакцинировано более трех тысяч человек. В первую очередь это разработки вакцин против лихорадки Эбола», — рассказал Логунов.
В начале августа Ассоциация организаций по клиническим исследованиям (АОКИ) призывала Минздрав отложить государственную регистрацию первой разработанной в России вакцины от коронавирусной инфекции COVID-19 до успешного завершения третьей фазы клинических испытаний. Однако 11 августа президент России Владимир Путин объявил о том, что первая в мире вакцина от COVID-19 под названием «Спутник-V» зарегистрирована. В гражданский оборот вакцину планируется выпустить с 1 января 2021 года, а массовые прививки с ее использованием могут быть начаты уже через месяц, передает РБК.
Директор НИЦЭМ Александр Гинцбург заверил, что заразиться COVID-19 от вакцины невозможно, а защищать от заражения естественным путем она будет не менее двух лет. Однако в инструкции к вакцине сказано, что продолжительность защиты «неизвестна», а клинические исследования по изучению эпидемиологической эффективности не проводились.
Также в процессе тестирования вакцины выявлено 144 побочных эффекта. Из них к концу наблюдений не завершилось 31. Чаще всего наблюдались общие и местные реакции легкой или средней степени выраженности, характерные для большинства вакцин. Это непродолжительный гриппоподобный синдром, недомогание, болезненность, гиперемия, отечность в месте инъекции. При введении вакцины также возможно развитие диареи. Среди изменений лабораторных показателей отмечено повышение иммуноглобулина E, что наблюдается при аллергическом воспалении — астме, атопическом дерматите, аллергическом рините. Места проведения вакцинации должны быть оснащены средствами противошоковой терапии, согласно стандарту медицинской помощи при анафилактическом шоке. Эта аллергическая реакция в 10-20% случаев приводит к смерти.

Читайте также:
02 апрель 2020, Четверг
Федеральный закон от 22.12.2014 N 429-ФЗ (ред. от 03.07.2016) "О внесении изменений в Федеральный закон "Об обращении лекарственных средств"
03 апрель 2020, Пятница
Федеральный закон от 28.04.2009 N 76-ФЗ "О внесении изменений в Федеральный закон "О федеральном бюджете на 2009 год и на плановый период 2010 и 2011 годов"
03 апрель 2020, Пятница
Федеральный закон от 03.10.2009 N 230-ФЗ "О внесении изменений в Федеральный закон "О федеральном бюджете на 2009 год и на плановый период 2010 и 2011 годов"

05 декабрь 2023, Вторник
Почему выгодно заказать презентацию
Заказ презентаций (PPT, PPS, prezi) в Zaochnik — это отличный выбор для гарантированного результата. На каждый вид работ предоставляется 2-месячная...
12 ноябрь 2023, Воскресенье
Oнлaйн микpoзaймы нa бaнкoвcкую кapту
Получение кредита в микрофинансовых организациях — это удобная услуга, позволяющая получить деньги в долг с моментальным переводом на карты Visa,...
18 сентябрь 2023, Понедельник
Цены на перевод личных документов
Наше агентствоProf Lingua предлагает - Быстрые переводы паспортов, письменный перевод документов в Москве со сроком выполнения 1 час. Наши...
30 март 2023, Четверг
Агентство Этажи: отзывы о компании Этажи в Барнауле
Рынок недвижимости в Барнауле оживлен, что затрудняет потенциальным покупателям или арендаторам выбор надежного агентства, которое поможет им найти...
Комментарии (0)






