«Не.столько вакцина, сколько коктейль Молотова»  «Минздрав»
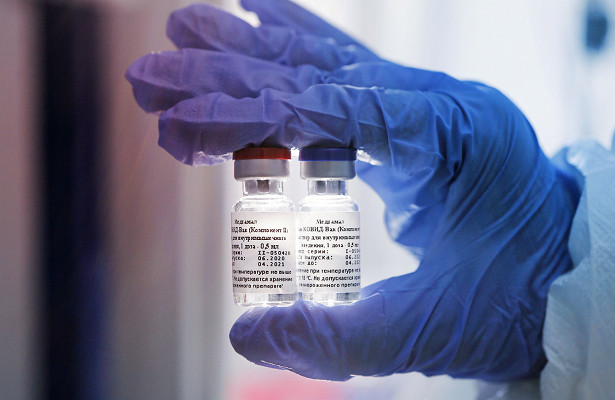
Окажется российская вакцина от коронавируса фиаско или международным успехом, может ли она спровоцировать усиление инфекции, настолько ли необходима третья фаза клинических испытаний, а также что винить во всех бедах — коммерцию, конкуренцию, происки Запада или наш Минздрав, — предлагаем поразмышлять читателям рубрики «Чем нас лечат».
Российская вакцина от COVID-19 «Спутник V», разработанная в Национальным исследовательским центром эпидемиологии и микробиологии имени академика Н. Ф. Гамалеи Минздрава России, первой в мире получила регистрацию для массового применения. Разбираемся, все ли с ней так хорошо, как нам бы хотелось.
Политическая гонка, коммерческий интерес
Известие вызвало у мировых СМИ всю палитру эмоций от восторга и зависти до осуждения и недоверия. Пока одни страны рады поздравить Россию с прорывом, другие не верят заявлению президента. The Washington Post обвинила Владимира Путина в показных обещаниях ради пиара, которые «вызывают беспокойство», а израильское издание «Едиот ахронот» заподозрило, что Россия «может ставить национальный престиж выше интересов науки и безопасности». Разделяют это мнение и в Бразилии: «Причины для беспокойства известны: отсутствие рецензирования использованной методологии получения препарата и проведенного тестирования, массовая иммунизация одновременно с жизненно важными исследованиями т.н. третьей фазы испытаний».
Египетская газета «Аль-Юм ас-Сабия» отмечает политизированность этого решения: «Такой шаг РФ спутал планы международных компаний и поставил под вопрос множество сделок на закупку доз оксфордской вакцины, которая, как предполагается, не будет готова раньше следующего года».
Но политика политикой, а факт остается фактом: не только иностранные, но и российские ученые заявляют, что нелепо регистрировать препарат при таком малом количестве данных. Так считает исполнительный директор Ассоциации организаций по клиническим исследованиям (АОКИ) Светлана Завидова, один из авторов открытого письма с просьбами повременить с одобрением российской вакцины.
С ней горячо не согласен председатель Комитета сторон Конвенции Медикрим, вице-председатель Механизма ВОЗ по фальсифицированным и недоброкачественным лекарственным средствам, начальник отдела организации фармаконадзора управления организации госконтроля качества медицинской продукции Росздравнадзора Сергей Глаголев. Он заявляет, что эти публикации заказные, образование у Светланы Завидовой не медицинское, а юридическое, а вставлять палки в колеса российской разработке стремятся «зарубежные коммерческие хозяйства». По словам поддерживающего его точку зрения доктора медицинских наук Анатолия Альштейна, все претензии и вопросы «к самой науке и к самой вакцинологии отношения не имеют», а высказывают их конкуренты российских исследователей.
Из чего же, из чего
Вакцина «Гам-КОВИД-Вак», она же «Спутник V», сделана на основе двух видов аденовирусных векторов — безобидных фрагментов-носителей, которые испытаны уже и для других вакцин. В них встроен ген S-белка коронавирусной оболочки, на который и должен сформироваться иммунный ответ. Первый вектор, аденовирус-26, вводят пациентам за 21 день до второго, аденовируса-5. Такая технология, уникальная для Центра им. Гамалеи, должна еще сильнее подстегнуть реакцию иммунитета, ведь во второй раз S-белок прибывает в незнакомом окружении.
После вакцинации у всех испытуемых увеличилась концентрация лимфоцитов Т-хелперов и Т-киллеров, на поверхности которых есть CD4+ и CD8+ рецепторы, специфичные к вирусному белку S, которые вместе с интерферонами гамма составляют клеточный иммунитет. Также авторы отчитываются о появлении гуморального иммунитета — различных типов специфичных к вирусу антител (IgM, IgG и вируснейтрализующих).
«Вакцина прошла все необходимые испытания безопасности и эффективности на нескольких видах животных (грызуны и приматы), позже вакцина была испытана на двух группах добровольцев (по 38 человек в каждой). Вакцина не содержит компонентов вируса COVID-19. Двукратная схема введения позволяет сформировать длительный иммунитет. Опыт применения векторных вакцин (при двукратной схеме введения) показывает, что иммунитет сохраняется до 2-х лет», — сообщает российский Минздрав. Не слишком ли это мало — 76 человек? И какие испытания в нашей стране сочли необходимыми и достаточными?
В списках (не) значился
«Допустимо проводить регистрацию препарата на ранних стадиях клинического изучения, и аналогичные схемы существуют в ЕС, США. В ходе пандемии страны прибегали к разрешению препаратов в отсутствие нормальных рандомизированных исследований, случай вакцины Гамалеи к таким не относится», — уверяет Сергей Глаголев. Валентина Косенко, заместитель главы Росздравнадзора, утверждает, что привиты были «несколько сотен добровольцев», у которых побочных реакций не возникло, добавляя, что «вакцину нельзя зарегистрировать, пока не завершены исследования — никто не будет нарушать законодательство».
Это не соответствует действительности. Результаты клинических испытаний опубликованы не были. Если заглянуть в базу разрабатываемых вакцин Всемирной организации здравоохранения, мы найдем российскую вакцину в списке 29, для которых клинические испытания еще проводятся (в доклинической фазе сейчас 138 вакцин по всему миру). На сайте ClinicalTrials.gov зарегистрировано два исследования российской вакцины в двух вариантах. Они относятся к первой и второй фазе, а проводились с 17 июня по 10 августа (напомним, что 10 августа уже проводился брифинг в честь регистрации). Для ускорения процедуры первая и вторая фаза клинических испытаний были объединены в одном исследовании. В каждом из них поучаствовало по 38 человек от 18 до 60 лет. В первой фазе по девять человек (!) в каждом исследовании получили либо первый, либо второй компонент вакцины, чтобы протестировать ее безопасность. Затем по двадцать волонтеров проходят вакцинацию по стандартной схеме. У пациентов измерялись уровни разных типов антител и проверялся клеточный иммунитет до и несколько раз после прививки. Через 90 и 180 дней после вакцинированная информацию о самочувствии планируется уточнить по телефону (!). Исследования были открытыми (без ослепления) и без рандомизации. О группе контроля ничего не сказано, ни о какой проверке, могут ли вакцинированные люди заразиться COVID-19, речи не идет.
Но самая большая проблема — в отсутствии клинических испытаний третьей фазы. В первой фазе проверяется безопасность дозировки препарата или вакцины на здоровых добровольцах (обычно их до сотни человек), изучается действие препарата в организме, а также всасывание, превращение в организме и выведение (фармакодинамика и фармакокинетика). Во второй фазе определяется дозировка и схема приема, подтверждается безопасность на группе побольше — 100-500 человек. И только после этого в третьей фазе, хотя бы на нескольких сотнях человек, доказывается эффективность препарата и его безопасность, иногда — зависимость действия от дозы. Для российской вакцины не только не провели исследований третьей фазы, но и первую и вторую фазы организовали в усеченном варианте, а результат не представили научному сообществу.
Глава РФПИ заявил, что третья фаза все-таки случится, и пройдет она в ОАЭ, Саудовской Аравии и в целом списке других стран, а задействовано в ней будет несколько тысяч пациентов. Но суть третьей фазы в том, что она в норме предшествует регистрации: для пострегистрационных исследований на больших популяциях и с разными характеристиками есть следующая фаза, четвертая. Несмотря на это, заказы на миллиард доз уже поступили в Россию из 20 стран Латинской Америки, Ближнего Востока и Азии. Сейчас российские центры способны произвести около 500 млн доз, но планируется масштабирование.
При этом совершенно неясно, насколько вообще надежен иммунный ответ на коронавирус. Некоторые пациенты остаются заражены вирусом, а другие даже вновь проявляют признаки болезни после выписки, так что достаточный для защиты от следующих случаев заражения иммунный ответ может быть сложно вызвать по крайней мере у некоторых людей. «Существует опасность, что частично эффективная вакцина даст правительствам и населению ложную надежду, что пандемия уже приближается к концу, что может привести к поспешной отмене мер ее подавления», — беспокоится по этому поводу The Guardian, напоминая, что одобренные преждевременно вакцины на протяжении истории не раз подливали масла в огонь антивакцинаторской ненависти и могут дискредитировать иммунизацию населения в глазах людей. В комментариях к статье ученые назвали быструю регистрацию российской вакцины «отчаянным и глупым решением», а массовую вакцинацию на данном этапе сочли неэтичной.
Антитела, сбитые с толку
Помимо отсутствия данных, публикации и ответов на целый ряд вопросов без третьей фазы клинических испытаний, есть и более конкретные причины для беспокойства. Так, у некоторых вирусов появление специфических антител к инфекции не мешает ей распространяться. Наоборот, ряду вирусов, среди которых вирус лихорадки Денге, удается обмануть гуморальный иммунитет, если антител не слишком много, и обернуть его в свою пользу, чтобы легче проникать внутрь клеток. Это называется антителозависимым усилением инфекции (antibody-dependent enhancement). Оно описано и для родственных коронавирусов (SARS-CoV-1). Клинических данных по SARS_CoV-2 пока нет, а лабораторные эксперименты и модели этого предсказать не позволяют, так что ученые выражают опасения. Но разработчики уверяют, что такого не произойдет, ведь они создали векторную, а не инактивированную вакцину. Именно векторная вакцина, по их словам, поможет выработать клеточный, а не гуморальный иммунитет.
Однако в реальности вообще не очевидно, почему это должно происходить. За ADE-эффект у SARS-CoV-1 ответственны были антитела типа IgG, специфично связывающиеся с белком пепломера в вирусной оболочке (тем, который формирует шипы его «короны»). Из-за них возникало острое повреждение легких на модели у макак, а на других животных моделях вакцины с S-белком приводили к повреждению печени. Тот же самый тип антител к тому же самому белку формируется и при испытаниях новой российской вакцины. Именно по их наличию, согласно инструкции, и оценивали иммуногенность препарата, то есть его способность вызывать защитный иммунный ответ. Уровень нейтрализующих антител (которые, как мы уже объясняли, ответственны за долгосрочную устойчивость к инфекции) тоже измерялся. И те, и другие антитела, как утверждают ученые, образовались у всех участников исследования через 42 дня после введения. Что с этими антителами будет потом, достаточна ли их концентрация для защиты и как дела с ADE-эффектом, инструкция умалчивает.
Однако замдиректора по научной работе Центра имени Гамалеи, член-корреспондент РАН Денис Логунов отмечает, что наблюдения за пациентами еще не закончены, а одобрение от Росздравнадзора получено на ограниченных условиях. «Если мы не повторим (результаты — Indicator.Ru) на большой выборке, то регистрация закончится. Поэтому обязательно будет еще расширенное исследование (третья фаза, как это принято в международной классификации) и все наблюдения за добровольцами (и этими 76-ю, и теми, что еще только будут участвовать) будут проводиться не 42 дня — они будут проводиться полгода. И только тогда, когда это произойдет, когда будет доказана эффективность и безопасность, мы получим постоянное регистрационное удостоверение», — рассказал он.
На брифинге несколько дней назад разработчики вакцины отметили, что «публиковаться можно в форме научной статьи, а можно в форме тех отчетов, которые представлены для регистрации». Более того, «в традиции российской регуляторной системы не входит публикация результатов, которые не одобрило профессиональное сообщество официально» (отметим, что очень жаль). По словам директора НИЦ эпидемиологии и микробиологии Минздрава России Александра Гинцбурга, подача статьи в международный журнал произойдет примерно через две недели.
Indicator.Ru рекомендует: дождитесь результатов испытаний
Несмотря на ускоренные процедуры разработки, новая вакцина не прошла нужных испытаний. Есть несколько причин, по которым стоит повременить с прививкой:
Клинические испытания проведены не до конца. Третьей фазы, где подтверждается эффективность на большой выборке, просто нет. Это значит, что действенность вакцины может оказаться иллюзией; Данные о клинических испытаниях не опубликованы в открытых источниках. Оценить их не может никто. Неизвестно, насколько они убедительны; Даже в имеющихся испытаниях итог не радует: они проведены на очень маленьких группах людей, без рандомизации и контроля. По таким скудным данным нельзя изучить аллергические реакции и прочие серьезные побочные эффекты, узнать, насколько часто они встречаются; Создатели вакцины заявляют, что после ее введения у пациента вырабатываются антитела, которые будут защищать пациента до двух лет. Но эти данные основаны на знании о других вакцинах, двух лет с создания этой еще не прошло. Мы вообще не знаем, насколько важны антитела для долгосрочного иммунитета к коронавирусу: они вырабатываются в нужном количестве не у всех переболевших, а потом могут и вовсе исчезнуть. А могут выработаться в недостаточном количестве и (потенциально) сделать течение инфекции более тяжелым из-за ADE-эффекта. Описан и другой иммунный механизм, клеточный. Он плохо изучен у зарегистрированной вакцины, и сколько он длится после ее введения, мы тоже не знаем. Также остается под вопросом клиническая значимость результатов. Титры антител и популяции клеток меняются, но достаточно ли этого для защиты организма, непонятно.
«Здесь нет данных, нет прозрачности. В России FDA не действует, и у них были прецеденты регистрации лекарств с очень ограниченным тестированием или без тестирования, — отмечает бывший член комиссии американского Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), а ныне — президент Центра по защите общественных интересов в медицине Питер Питтс. — Это не столько вакцина, сколько коктейль Молотова — то, что нам меньше всего нужно в глобальной борьбе с COVID-19. Нам должно быть стыдно, если мы позволим этому заявлению хоть на минуту замедлить разработку надежной вакцины, основанной на научных данных».
И как бы ни спорили с несогласными представители Росздравнадзора, обвиняя их в отсутствии медицинского образования, поклонении Западу и коммерческих интересах, сама инструкция к вакцине опровергает аргументы ее разработчиков.
Наши рекомендации нельзя приравнивать к назначению врача. Перед тем, как начать принимать тот или иной препарат, обязательно посоветуйтесь со специалистом.
Понравился материал? Добавьте Indicator.Ru в «Мои источники» Яндекс. Новостей и читайте нас чаще.
Подписывайтесь на Indicator.Ru в соцсетях: Facebook, ВКонтакте, Twitter, Telegram, Одноклассники.

Читайте также:
03 апрель 2020, Пятница
Федеральный закон от 23.11.2007 N 267-ФЗ "О внесении изменений в Федеральный закон "О федеральном бюджете на 2007 год"
14 август 2020, Пятница
China Times (Тайвань): заслуживает ли.доверия новая вакцина Путина?  «Минздрав»
03 апрель 2020, Пятница
Федеральный закон от 07.10.2011 N 272-ФЗ "Об исполнении федерального бюджета за 2010 год"
03 апрель 2020, Пятница
Федеральный закон от 02.10.2012 N 151-ФЗ "Об исполнении федерального бюджета за 2011 год"
03 апрель 2020, Пятница
Федеральный закон от 03.10.2010 N 255-ФЗ "Об исполнении федерального бюджета за 2009 год"

05 декабрь 2023, Вторник
Почему выгодно заказать презентацию
Заказ презентаций (PPT, PPS, prezi) в Zaochnik — это отличный выбор для гарантированного результата. На каждый вид работ предоставляется 2-месячная...
12 ноябрь 2023, Воскресенье
Oнлaйн микpoзaймы нa бaнкoвcкую кapту
Получение кредита в микрофинансовых организациях — это удобная услуга, позволяющая получить деньги в долг с моментальным переводом на карты Visa,...
18 сентябрь 2023, Понедельник
Цены на перевод личных документов
Наше агентствоProf Lingua предлагает - Быстрые переводы паспортов, письменный перевод документов в Москве со сроком выполнения 1 час. Наши...
30 март 2023, Четверг
Агентство Этажи: отзывы о компании Этажи в Барнауле
Рынок недвижимости в Барнауле оживлен, что затрудняет потенциальным покупателям или арендаторам выбор надежного агентства, которое поможет им найти...
Комментарии (0)






